Proje 7
Proje Adı
Anti-IL-1 Etkinlik Gösteren Biyolojik Ürünlerin In Vitro ve In Vivo Koşullarda Preklinik Etkinliğinin ve Toksisitesinin Değerlendirilmesi
Sorumlu APYK
İstanbul Üniversitesi
Stratejik Hedef Adı
Projenin Özeti
Preklinik etkililik ve güvenlilik çalışmaları ilaç keşfi ve geliştirme sürecinin temel unsurlarından birisidir ve ayrıca bilginin laboratuardan kliniğe çevriminde kritik öneme sahiptir. İyi laboratuvar uygulamaları (ILU) geliştirilecek ilaçların preklinik etkililik ve güvenliliğinin değerlendirmesi için preklinik çalışmaların tasarımı, yürütülmesi, raporlanması ve dokümantasyonu ile ilgili bir uluslararası kurallar bütünüdür. Bu kurallara uyum uluslararası geçerlilik ve çalışma etiği açısından önemlidir. Diğer taraftan yürütülen proje ile ilgili olarak çalışma tasarımı ve yürütülmesi için ICH tarafından yayımlanan “biyoteknolojik farmosötiklerin preklinik güvenlilik değerlendirmesi kılavuzu” yol gösterici uluslararası geçerliliği olan bir dokümandır. (ICH guideline S6 (R1) – preclinical safety evaluation of biotechnology-derived pharmaceuticals, https://www.ema.europa.eu/en/documents/scientific-guideline/ich-s6r1-preclinical-safety-evaluation-biotechnology-derived-pharmaceuticals-step-5_en.pdf)
Bu alt projenin temel amacı geliştirilecek Anti-IL-1 etkinlik gösteren biyolojik ürünlerin uluslararası ILU ve ICH kılavuzunda belirtilen kurallarına uygun preklinik etkililik ve güvenlilik çalışmalarının gerçekleştirilmesidir.
Ülkemizde ilaç geliştirmede özellikle de biyoteknolojik ilaçların geliştirilmesinde dar boğazların başında preklinik toksisite çalışmaları gelmektedir. Bu kısıtlılığın temel sebepleri, akademik anlamda yeteri kadar teorik bilgi ve deneyim olmasına karşın, üniversitelerin ve yerli endüstrinin bu alandaki teorik bilgiyi uygulamaya dönüştürecek düzeyde tecrübesinin olmaması ve “preklinik toksikoloji” gibi başlı başına kendine özgü kuralları, kılavuzları olan bir disiplinde özelleşmiş merkezlerin bulunmamasıdır.
Preklinik güvenlilik çalışmalarında, in vitro çalışmaların yanı sıra, in vivo araştırmalarda uygun hayvan türünün belirlenmesi, yaşı, fizyolojik durumu, uygulanacak ilacın dozu, uygulama yolu ve tedavi rejimi ve test ürünün uygulama koşullarındaki stabilitesi mutlaka dikkate alınmalıdır. Bu temel unsurlar dikkate alınarak ilaçların toksisitesi in vitro ve in vivo koşullarda değerlendirilmektedir. Ayrıca, ilaçların ruhsat alması aşamasında bu incelemelerin yapıldığı laboratuvarların GLP (Good Laboratory Practice, İyi Laboratuvar Uygulamaları) belgelerinin olup olmadığı özellikle uluslararası pazar hedeflendiğinde önem taşımaktadır.
Gerçekleştirilecek bu alt çalışmada aşağıdaki adımların izlenmesi planlanmaktadır:
1) Anti-IL-1 etkinlik gösteren biyolojik ürünlerin farmakolojik profillerinin çıkarılması
2) Anti-IL-1 etkinlik gösteren biyolojik ürünlerin preklinik toksisite çalışmaları
3) İstanbul Üniversitesi bünyesinde ileride yapılacak çalışmalar için referans preklinik etkililik ve güvenlilik birimi kurulması
Proje kapsamında geliştirilecek biyoteknolojik ürünlerin preklinik değerlendirmesi, bu alanda yetişmiş insan gücü, teknoloji transferi ve ülkemizde preklinik etkililik ve güvenlilik çalışmalarının değerlendirileceği referans bir birimin kurulması projenin temel çıktılarını oluşturmaktadır.
INFLAMIST projesi yukarıda belirtildiği üzere İlaç Ar-Ge’si için en temel basamaklardan olan preklinik etkililik ve güvenlilik değerlendirilmesi için ülkemizde var olan açığın kapatılması için örnek bir proje olacak ve proje sonunda kurulacak birim ve bu alanda yetişmiş insan gücü, inflamasyon ve immunoloji alanında geliştirilecek ürünler için hem akademi hem de endüstri açısından bir irtibat noktası ve büyük bir kazanım olacaktır.
Proje spesifik çıktıların potansiyel uygulama alanı olan monogenik ve kompleks inflamazom ilişkili hastalıkların tedavisinde anti-IL-1 etkili biyolojik ilaç olarak kullanılması projenin en temel yaygın etkisini oluşturacaktır.
Hedeflenen Proje Çıktısı ve Sonucu
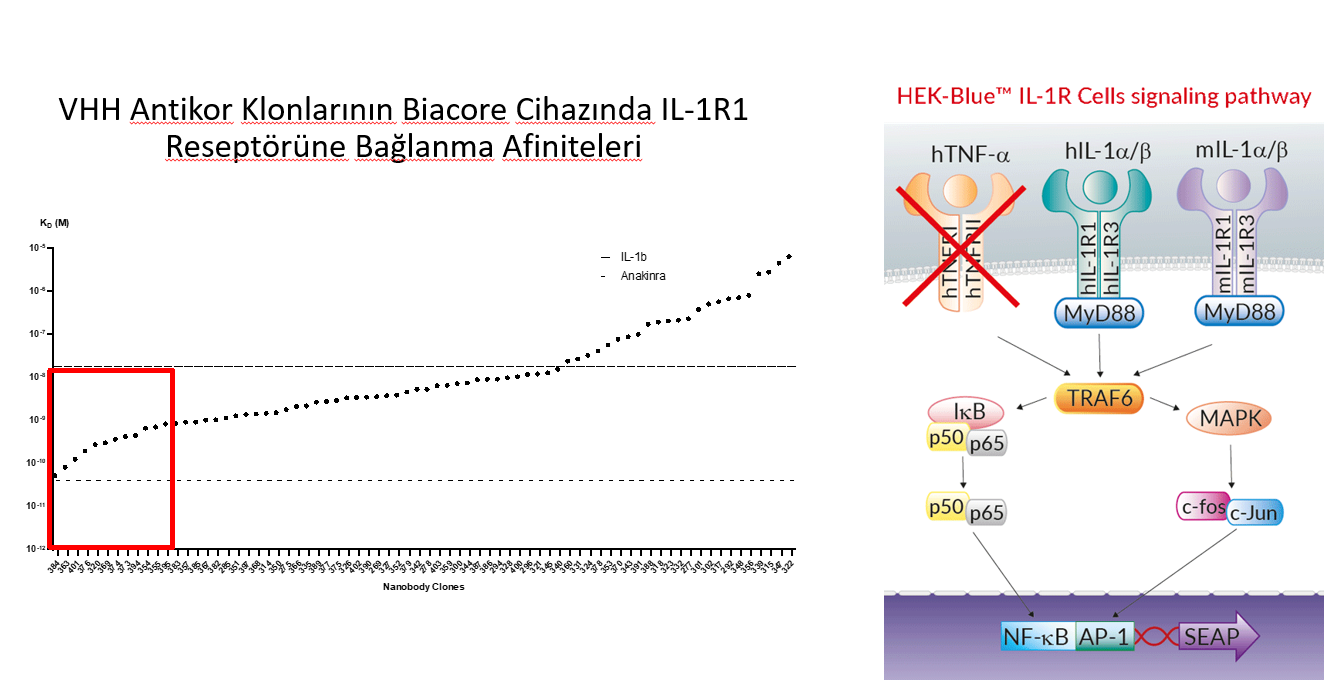
Geliştirilen ürünlerin IL-1Ra afiniteleri Biacore cihazıyla ölçülmekte olup, IL-1R1 taşıyan HEK-Blue hücre hatlarında SEAP yöntemiyle IL-1 sitokinleriyle hücre içine uyarı iletilmesinin inhibisyon testleri yapılmaktadır. Son ürünlerin test edileceği hayvan modelleri ve in vitro testler seçilmiş olup, preklinik testler konusunda Belçika, Almanya ve Fransa’daki araştırma merkezleriyle anlaşmalar yapılmıştır. Bu amaçla hazırlanan bir ERDERA başvurusu ilk aşamayı yüksek puanlarla geçmiş olup, değerlendirmenin ikinci aşamasındadır.